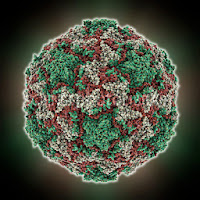
Naukowcy z University of Wisconsin-Madison przy wykorzystaniu sekwencjonowania genetycznego opracowali trójwymiarowy model słabo opisanego Rinowirusa C, jednego z patogenów odpowiadających najpopularniejszą chorobę – przeziębienie.
Wyniki prac zespołu kierowanego przez profesor Ann Palmenberg opublikowano w czasopiśmie Virology. Dostarczyły one dokładnego modelu kapsydu (białkowej otoczki) gatunku wirusa przeziębienia, który został opisany dopiero w 2006 roku. Badanie pokazało, jak bardzo różni się on od innych szczepów. Według profesor Palmenberg opisana przez nią struktura otoczki wyjaśnia większość niepowodzeń podczas testów leków przeciwirusowych wiążących się do białek kapsydu i skierowanych przeciwko rinowirusom.
Dwa oblicza przeziębienia: pomiędzy
białkami opłaszczającymi niedawno odkrytego i praktycznie
niezbadanego Rinovirusa C (po prawej) i powszechnie znanego
Rinovirusa A (po lewej) występują istotne różnice. Wyjaśnia to,
dlaczego do tej pory nie mamy skutecznego leku na zwykłe
przeziębienie.
Rinowirus C jest podejrzewany o wywoływanie ponad połowy dziecięcych przeziębień i może stanowić zagrożenie w połączeniu z innymi chorobami układu oddechowego, takimi jak na przykład astma. Wiązany jest też ciężkimi chorobami dolnych dróg oddechowych. Wraz z wcześniej opisanymi Rinowirusami A i B jest odpowiedzialny za miliony zachorowań rocznie, co w samych Stanach Zjednoczonych przynosi straty rzędu 40 miliardów dolarów.
Rinowirusy A i B są od dawna znane nauce. Dokładny opis (w tym trójwymiarowej struktury) zawdzięczają temu, że można je łatwo namnażać w warunkach laboratoryjnych. RV-C jest trudny w hodowli i dlatego pozostawał niezauważony do roku 2006, kiedy to nowe techniki sekwencjonowania genetycznego i zastosowanie mikromacierzy DNA pozwoliły odkryć patogen czający się w ludzkich komórkach, tuż obok doskonale znanych braci.

Ludzkie rinowirusy zostały po raz pierwszy wyizolowane w roku 1956 przez Winstona H. Price. Obecnie na podstawie badań genetycznych zostały zakwalifikowane do rodzaju enterowirusów. Są bardzo małe - mają jedynie 30 nanometrów. Ich materiał genetyczny to pojedyncza nić RNA o długości od 7,2 do 8,5 kpz. Do tej pory opisano ponad 180 różnych serotypów rinowirusów A, B i C. Dlatego przy obecnym poziomie technologii nie jest możliwe stworzenie na nie szczepionki. Infekcja przez nie powodowana może być przenoszona zarówno za pomocą aerozoli (kichanie), jak i przez bezpośredni kontakt fizyczny. W zapobieganiu infekcji całkiem skuteczny jest interferon-α podawany do nosa, jednak jego dłuższe przyjmowanie powoduje objawy bardziej uciążliwe niż samo przeziębienie...
Model wirusa został stworzony in silico za pomocą zaawansowanych narzędzi bioinformatycznych i przy wykorzystaniu wyników sekwencjonowania genomów 500 wirusów. W 2009 roku ten sam zespół badawczy brał udział w stworzeniu map genomowych wszystkich znanych wirusów wywołujących przeziębienie.
Opisanie struktury otoczki zwiększa prawdopodobieństwo na stworzenie skutecznych leków przeciwko przeziębieniom. Leki przeciwko wirusom przeziębienia typu A i B są już opracowane i przechodzą testy kliniczne. Jednak ich ich efektywność jest obniżona, ponieważ tak są opracowane, aby pasować do budowy znanych szczepów, która została opisana lata temu z wykorzystaniem krystalografii rentgenowskiej (jest to technika do dziś powszednie wykorzystywana do badania struktury cząsteczek). Elementy budowy kapsydu RV-C odpowiedzialne za wiązanie się do komórki i omijanie układu odpornościowego różnią się jednak od gatunków A i B.
Dzięki opisaniu struktury możliwe jest opracowanie nowego leku przeciwwirusowego. Jak zaznacza Holly Basta z UW-Madison Institute for Molecular Virology, żaden z istniejących leków nie działa na RV-C.
Leki przeciwwirusowe działają poprzez przyczepienie się lub zmodyfikowanie powierzchni patogenu. Efektywność zależy od dopasowania właściwych elementów układanki – budowy leku i białek wirusa. Brak trójwymiarowej struktury RV-C powodował, że firmy farmaceutyczne próbujące opracować lek na przeziębienie błądziły po omacku – wirus ma zupełnie inny receptor i miejsce wiązania. Dlatego trzeba opracować inne rozwiązanie.
Opracowanie: Seweryn Frasiński
Źródła:
Modeling of the human rhinovirus C capsid suggests possible causes for antiviral drug resistance. dx.doi.org/10.1016/j.virol.2013.10.004
Modeling of the human rhinovirus C capsid suggests a novel topography with insights on receptor preference and immunogenicity. dx.doi.org/10.1016/j.virol.2013.10.006
Engelberg N.C. 2012. Schaechter’s Mechanisms of Microbial Disease, Lippincott Williams & Wilkins


WYKOP QRWA
OdpowiedzUsuńJestem niemal pewny, ze to 40milionow dolarow to duzo za mala kwota jak na strtay wywolane chorobami w USA
OdpowiedzUsuńsłuszna uwaga, z rozpędu zbyt mocno obniżyłem amerykańskie biliony :) poprawione
UsuńWykop, k...a! ;-) gratuluję 'głównej'.
OdpowiedzUsuń:) rozkręcamy się
OdpowiedzUsuń