Dzięki opracowaniu nowej techniki znakowania chromosomów X zielonym i czerwonym barwnikiem fluorescencyjnym, naukowcy mogą teraz dokładniej niż kiedykolwiek obserwować wciąż tajemnicze zjawisko lionizacji – wyciszenia u kobiet jednego z pary posiadanych przez nie chromosomów płciowych X.
Historia zaczyna się w w roku 1891,
kiedy to Hermann Henking obserwując podział mejotyczny komórek
pluskwiaka zauważył coś, czego nie powinno tam być. Wśród
chromosomów znalazł grudkę chromatyny, która nie miała swojej
pary. Nie zdołał określić jej przeznaczenia i opisał odkrycie jako „element X”, później nazwany dodatkowym chromosomem.
10 lat później pojawiła się sugestia, że może on odpowiadać za
płeć męską (1).
W 1905 roku
badaczka Nettie Stevens w
komórkach żuka odkryła wcześniej
przeoczony chromosom Y (nie nazwała go, jak się mylnie powszechnie
sądzi, z uwagi na kształt; po prostu “Y” jest kolejną litera
po “X”). Udowodniła jednocześnie, że
w komórkach żeńskich są dwa chromosomy X. W męskich to Y jest
parą dla X (1). Reguła ta odnosi się oczywiście do gatunków, które
mają taki typ determinacji płci. Czyli u większości ssaków, niektórych owadów i
drzew. W przyrodzie występują też inne metody determinacji płci.
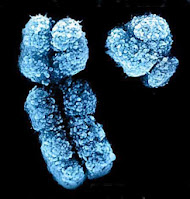
Chromosomy X i Y, kolorowane zdjęcie z mikroskopu elektronowego.
Jednak
im dalej tym sprawa z chromosomem X się komplikuje. Osobniki
żeńskie posiadają dwa chromosomy X – jeden z komórki jajowej, drugi z
plemnika. Pod koniec lat 50 Japończyk Susumu Ohno odkrywa, że w
komórkach żeńskich jeden z tych chromosomów jest nieaktywny i
pozostaje zwinięty w ciałko Barra (odkryte nieco wcześniej w 1949). Jak
się szybko okazało, chromosomy wyłączane
są według losowego wzoru
i to wśród
komórek tego samego osobnika.
Mówiąc prościej, część komórek samicy ma aktywny chromosom X od matki a część od ojca. W pewnym momencie rozwoju embrionu podejmują decyzję, który X z pary ma być wyciszony. Co ciekawe, zachodzi to dwukrotnie - najpierw w komórkach tworzących łożysko, później w tych wysłanych do zbudowania embrionu (2). Wyłączana jest większość genów (ale nie wszystkie). Gdy komórki dzielą się tworząc tkanki i organy, ich potomstwo trzyma się tego wyboru. Pomimo lat badań wciąż stosunkowo słabo poznane są procesy, które kierują tym mechanizmem. Nie znamy też jego ewolucyjnych podstaw. Samo wyciszenie realizowane jest epigenetycznie przez centrum inaktywacji na chromosomie, które zawiera głównie geny kodujące specjalne cząsteczki RNA. Najważniejszym z nich jest gen Xist, którego transkrypty RNA otaczają wyłączany chromosom i blokują jego geny.
Takie wyłączenie jest koniecznie, ponieważ obecność 2 chromosomów tego samego typu powoduje nadprodukcję kodowanych na nich białek, całkowicie rozregulowując komórkę. Myszy z usuniętym genem Xist chorują m.in. na agresywne nowotwory najprawdopodobniej w wyniku wybudzenia uśpionego chromosomu (3).
Mówiąc prościej, część komórek samicy ma aktywny chromosom X od matki a część od ojca. W pewnym momencie rozwoju embrionu podejmują decyzję, który X z pary ma być wyciszony. Co ciekawe, zachodzi to dwukrotnie - najpierw w komórkach tworzących łożysko, później w tych wysłanych do zbudowania embrionu (2). Wyłączana jest większość genów (ale nie wszystkie). Gdy komórki dzielą się tworząc tkanki i organy, ich potomstwo trzyma się tego wyboru. Pomimo lat badań wciąż stosunkowo słabo poznane są procesy, które kierują tym mechanizmem. Nie znamy też jego ewolucyjnych podstaw. Samo wyciszenie realizowane jest epigenetycznie przez centrum inaktywacji na chromosomie, które zawiera głównie geny kodujące specjalne cząsteczki RNA. Najważniejszym z nich jest gen Xist, którego transkrypty RNA otaczają wyłączany chromosom i blokują jego geny.
Takie wyłączenie jest koniecznie, ponieważ obecność 2 chromosomów tego samego typu powoduje nadprodukcję kodowanych na nich białek, całkowicie rozregulowując komórkę. Myszy z usuniętym genem Xist chorują m.in. na agresywne nowotwory najprawdopodobniej w wyniku wybudzenia uśpionego chromosomu (3).
Posiadanie dwóch
chromosomów tego samego typu aktywnych jednocześnie w obrębie
ciała daje samicy większa różnorodność genetyczną w porównaniu
do samców. Są na nich geny kodujące to samo, na tych samych miejscach a jednak jakościowo mogą się różnić. Samice
są więc komórkowymi mozaikami. Ludzie posiadają na tym
chromosomie ok. 1100
genów, jednak skutki opisywanego procesu nie są zauważalne. Owszem,
możemy spotkać człowieka, którego oczy lub włosy będą miały dwa
różne kolory, ale jest to mozaicyzm somatyczny, mające zupełnie inne podłoże, nie związane z
wyłączeniem chromosomu X.
Nieco więcej "szczęścia"
mają myszy, u których na chromosomie X znalazły się niektóre
geny kodujące kolor sierści. Właśnie ten
fakt wykorzystała na
początku lat 60 Mary Lyon, która
eksperymentując myszach powiązała cętki i łaty u
heterozygotycznych zwierzaków z inaktywacją jednego z chromosomów
X. Na cześć odkrywczyni zjawisko inaktywacji X zostało nazwane
lionizacją, a jej hipoteza, że występuje ono u wszystkich ssaków
szybko się potwierdziła.
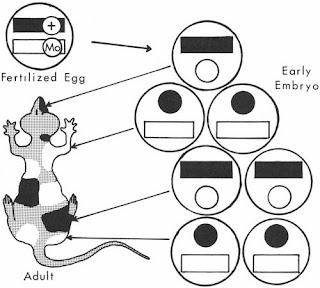
“Łaciata” mysz z
badania Mary Lyon. Po prawej stronie znajduje
się schemat wczesnego embrionu. Wyłączona
kopia chromosomu X oznaczona jest kółkiem a
aktywna prostokątem. Figury ciemne oznaczają włączony gen
kodujący ciemną barwę sierści (+). Chromosomy oznaczone figurami
białymi maja zmutowaną wersję genu (Mo), nie dająca zabarwienia
(Lyon 1963)
Podejrzewa
się, że większa różnorodność genetyczna u kobiet może być
jednym z powodów ich mniejszej śmiertelności i dłuższej średniej
życia. Mężczyźni posiadający jeden
chromosom X są też znacznie bardziej narażeni na choroby genetyczne
związane z mutacjami jego genów. Mechanizm inaktywacji stwarza też
problemy przy badaniach nad komórkami macierzystymi i w ich praktycznym wykorzystaniu. Dlatego tak ważne jest dokładne opisanie
procesu.
Na początku roku
zespół badaczy z Johns Hopkins University
School of Medicine opublikował w Nature
badanie pozwalające zobaczyć ten proces w nowym świetle. Efektownie pokazali,
że komórki w których aktywne są różne kopie X tworzą niezwykle
złożone struktury w tkankach i całych organach. Kilka lat temu
zespół opracował wydajną metodę
znakowania komórek. Do chromosomu X udało sie im wprowadzić geny
markerów GPF i tdTomato (zielonego i czerwonego białka
fluorescencji) i mechanizm ich aktywacji za pomocą rekombinazy Cre
(dzięki czemu można wybrać, w którym organie
lub tkance znakowanie będzie włączone).
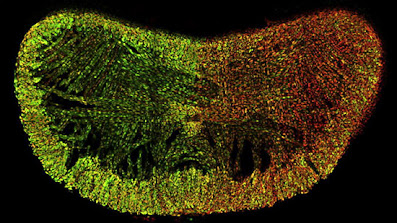
Mapy wzoru inaktywacji określonego chromosomu X (zielony GFP - aktywny matczyny, czerwony tdTomato) w organach myszy. Zgodnie z ruchem zegara od górnego prawego zdjęcia: rogówka oka, skóra, chrząstka, ucho wewnętrzne. Mikroskop fluorescencyjny (Wu i Nathans, 2014)
Naukowcom
udało się wyhodować dwie linie myszy, z których jedna miała
chromosom X produkujący w komórkach zielony barwnik, a druga
czerwony. Po ich skrzyżowaniu zbadali ich żeńskie potomstwo. Pod
mikroskopem fluorescencyjnym pojawiły się niesamowite obrazy
mozajek
kontrastujących kolorów, tworzonych przez
komórki z aktywnym chromosomem
X matki i tych z
włączonym chromosomem X ojca.
Nie było zaskoczeniem,
że komórki takie mogą znajdować się obok siebie. Jednak badanie
preparatów z mógu
pokazało ciekawe zależności: w prawej półkuli dominowały
komórki z aktywnym chromosomem X ojca, w lewej – matki. Organy
mogą być zdominowane w całości. U niektórych myszy jedno oko
było zdominowane przez aktywny X
jednego rodzica, a drugie innego.
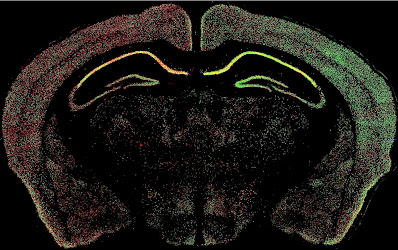
Przekrój mózgu samicy myszy, wzór wyciszenia chromosomów X. Według autorów takie nierównomierne rozłożenia mogą mieć wpływ na określone funkcje mózgu. Mikroskop fluorescencyjny (Wu i Nathans, 2014)
Często podaje się, że
inaktywacja chromosomów X rozkłada się po połowie. Jednak wyniki
wskazują na coś innego. Niektóre zwierzęta były prawie całkowicie
zdominowane przez chromosom tylko jednego rodzica.
Według
kierownika badania prof. Jeremiego Nathansa z Johns
Hopkins University, technika pozwala w
niesamowity sposób pokazać to, co odkryła Mary Lyon pół wieku
temu. Ponieważ ojcowski i matczyny chromosom niosą nieco inne geny,
zdominowane przez jeden z nich nie tkanki i narządy mogą zachowywać
się inaczej niż reszta ciała.
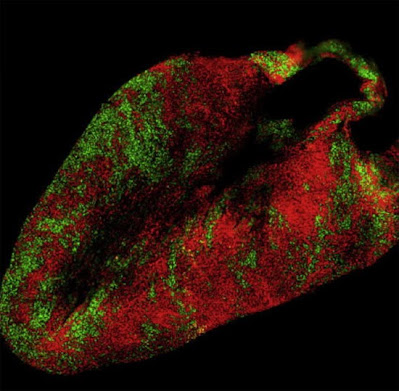
Przekrój języka samicy myszy i powierzchnia serca. Wzór wyciszenia określonego chromosomu X. Mikroskop fluorescencyjny (Wu i Nathans, 2014)
W sposób bolesny mogą się o tym przekonać osoby cierpiące na choroby związane z
mutacjami genów na chromosomie X. Mężczyźni nie mają pola
manewru. Jeżeli są nosicielami
– chorują. Tak samo kobiety-homozygoty posiadające oba obciążone
chromosomy X. Sprawa komplikuje się u nosicielek-hetereozygot. Kobiety z mutacją powodującej chorobę Norrie które
mogą być całkowicie zdrowe, chorować lekko lub ciężko i to z
rozróżnieniem na jedno lub drugie oko. Winę za chorobę ponosi gen
białka regulującego powstawanie naczyń krwionośnych w siatkówce;
nieprawidłowości przez niego powodowane prowadzą do ślepoty.
Dlatego
zespół prof. Nathansa
przeprowadził badania na myszach z mutacją
odpowiadającą
za chorobę Norrie.
Potwierdzono, że wadliwa struktura naczyń
krwionośnych pokrywa się z lokalizacją aktywnych chromosomów z
mutacją.
Preparaty prawej i lewej siatkówki myszy modelowej dla choroby Norrie. Ewentualny rozwój ślepoty zależy od dominacji komórek z obciążonym mutacją chromosomem X a także wzorów i wielkości ziarnistości przez nie tworzonych. (Wu i Nathans, 2014)
Profesor Nathans nazywa
proces inaktywacji chromosomu X fascynującym aspektem biologii
ssaków. Współtwórca opisywanej techniki wizualizacji przewiduje,
że może szczególnie przydatna do badania wpływu
chromosomów X na rozwój mózgu, a przykład różnic pomiędzy lewą
a prawa półkulą żeńskiego mózgu, różnic w jego strukturze
pomiędzy płciami, oraz omiędzy rożnymi kobietami włączając w to
bliźnięta jednojajowe.
Dokładne poznanie procesu inaktywacji chromosomu X jest tez konieczne, ponieważ jak wcześniej wspomniano stwarza problemy z komórkami macierzystymi. Kiedy w laboratorium hodowane są żeńskie komórki macierzyste (na przykład do wykorzystania w leczeniu), czasami wyłączający jeden X gen Xist przestaje działać. Przeszczepienie takich "popsutych" komórek macierzystych pacjentowi może mieć katastrofalne skutki. Żeby nie było zbyt łatwo, według profesor Edith Heard wzory inaktywacji chromosomu X u ludzi i myszy używanych jako modele badawcze nieco się od siebie różnią (4).
Dokładne poznanie procesu inaktywacji chromosomu X jest tez konieczne, ponieważ jak wcześniej wspomniano stwarza problemy z komórkami macierzystymi. Kiedy w laboratorium hodowane są żeńskie komórki macierzyste (na przykład do wykorzystania w leczeniu), czasami wyłączający jeden X gen Xist przestaje działać. Przeszczepienie takich "popsutych" komórek macierzystych pacjentowi może mieć katastrofalne skutki. Żeby nie było zbyt łatwo, według profesor Edith Heard wzory inaktywacji chromosomu X u ludzi i myszy używanych jako modele badawcze nieco się od siebie różnią (4).
Rzęska komórki ucha wewnętrznego samicy myszy. Wzór wyciszenia określonego chromosomu X. Mikroskop fluorescencyjny (Wu i Nathans, 2014)
Opracowanie: Seweryn Frasiński
PODOBAŁA CI SIĘ TA TREŚĆ? CHCESZ BYĆ NA BIEŻĄCO Z KOLEJNYMI ARTYKUŁAMI?
Źródła:
Sturtevant A.H. A
History of Genetics (2001) The Electronic Scholarly Publishing
Project.
Chow J., Heard E. X inactivation and the complexities of silencing a sex chromosome (2009) DOI:10.1016/j.ceb.2009.04.012.
Lee J.T., Bartolomei M.S. Xist RNA Is a Potent Suppressor of Hematologic Cancer in Mice (2013) DOI:10.1016/j.cell.2013.01.034
Heard E., Mongelard F. Human XIST yeast artificial chromosome transgenes show partial X inactivation center function in mouse embryonic stem cells (1999) PMCID: PMC22003
Chow J., Heard E. X inactivation and the complexities of silencing a sex chromosome (2009) DOI:10.1016/j.ceb.2009.04.012.
Lee J.T., Bartolomei M.S. Xist RNA Is a Potent Suppressor of Hematologic Cancer in Mice (2013) DOI:10.1016/j.cell.2013.01.034
Heard E., Mongelard F. Human XIST yeast artificial chromosome transgenes show partial X inactivation center function in mouse embryonic stem cells (1999) PMCID: PMC22003






Ciekawy artykuł :) na pewno wrócę tu nie raz, ponieważ ten blog fajnie rozwija horyzonty!
OdpowiedzUsuń